34 ี ่าลดทอนเหมือนกัน สารที่มค จัดว่าอยูใ่
26 Slides406.50 KB

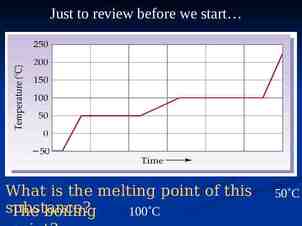
34 ี ่าลดทอนเหมือนกัน สารที่มค จัดว่าอยูใ่ นสภาวะที่สอดคล้องกัน มีแนวโน้มที่จะมีสมบัติคล้ายคลึงกัน จากหลักของสภาวะที่สอดคล้อง และค่าวิกฤตต่างๆ จะสามารถหาค่า P, V และ T ได้
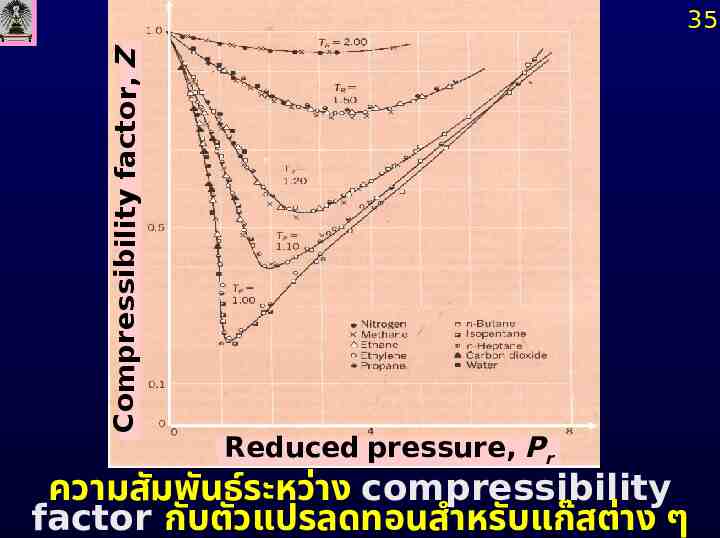
Compressibility factor, Z 35 Reduced pressure, Pr ความสัมพันธ์ระหว่าง compressibility factor กับตัวแปรลดทอนสำหรับแก๊สต่าง ๆ

อุ ณหภูมส ิ ม ั บูรณ์ 36 (ABSOLUTE TEMPERATURE) มาตราอุ ณหภูมข ิ องแก๊ส อุ ดมคติ ( Ideal Gas ใช้สมการของแก๊ สอุ ดมคติ PV Temperature RT เพื่อ Scale) กำหนดอุ มิ PV ที่ P ต่ำ ณ แก๊หภู สจะมี 0 เมื่อ T o ต่ำกว่า -273 C

37 มินี้เป็นขีดจำกัดล่างของมาตราอุ ณหภ า อุ ณหภูมศ ิ ูนย์สม ั บูรณ์ (absolute perature) ไม่สามารถทำให้ แก๊สมีอุณหภูมล ิ ดลง งศาสัมบูรณ์ได้ จึงใช้ อุ ณหภูมท ิ ี่จุด (triple point temperature, T อุ ณหภูมศ ิ ูนย์สม ั บูรณ์
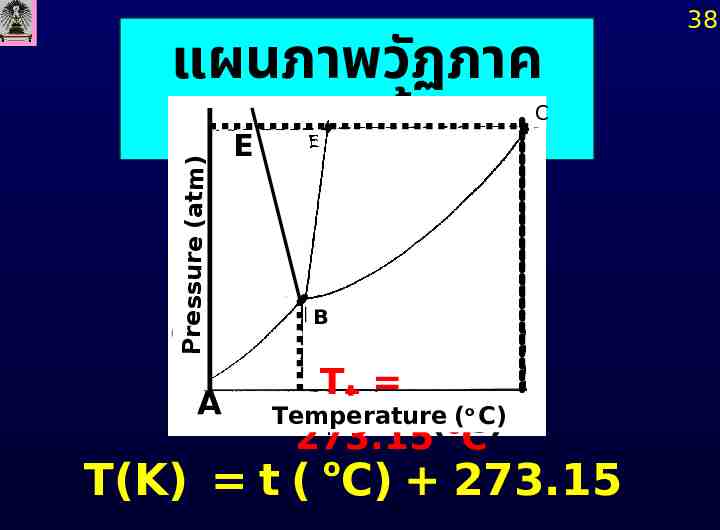
แผนภาพวัฏภาค E ของน้ำ Pressure (atm) C A B Tt o(o C) Temperature (o C) 273.15 C o T(K) t ( C) 273.15 38

สมการของสถานะสำหรับแก๊สจริง 39 UATION OF STATE FOR REAL n der Waals เสนอว่า 1. ความดันของแก๊ส เกิดจากการที่ โมเลกุลของแก๊ส เคลื่อนที่ชนผนังภาชนะ ถ้าแก๊สมี แรงดึงดูด ระหว่างโมเลกุล ความดันแก๊สที่วด ั ได้จะน้อยกว่า

40 (1) แรงที่ชนผนังภาชนะลดลง ต ความเข้มข้นของโมเลกุล (n / V) (2) จำนวนครัง ้ ของการชนลดลง ต ความเข้มข้นของโมเลกุล (n / V) ความดันที่ลดลง ต n2 Pideal Preal a n2 V 2 ค่าคงที่ ขึน ้ กับแรงดึงดูดระหว่างโมเล

41 ี ริมาตรโมเลกุล 2. แก๊สอุ ดมคติไม่มป แต่แก๊สจริง มีปริมาตรโมเลกุล ปริมาตรส่วน หนึ่งของภาชนะ โมเลกุ ลของแก๊ ถ้าใส่ ่โมเลกุ ปริจะมี มาตรที ลใหม่สไอยู ม่ส่ ามารถ โมเลกุ ลใหม่ ข้าไป ่เข้าเไปได้ เคลื่อนที ่ได้เฉพาะช่ นที ่ถก เรีจะเคลื ยกว่า ่ อ ปริ มาตรที ู กีอ ดงว่ กันางที่เหลือ Videal Vreal (excluded volume, b )-

L GAS EQUATION : 42 PV nR N DER WAALS EQUATION: (P a n2 )( V - nb ) nRT V2

ทฤษฎีจลน์ของแก๊ส อุ ดมคติ 43 OF ฤษฎี(KINETIC นี้อาศัยข้อสมมุTHEORY ติดังนี้ 1. แก๊สอุ ดมคติประกอบด้วยโมเลกุลที่ IDEAL GASES) มีมวล แต่ไม่มี ปริมาตร 2. โมเลกุลของแก๊สเคลื่อนที่ตลอด เวลา ทุกทิศทาง อย่างไม่เป็นระเบียบ โดยการ เคลื่อนที่แบบเลื่อนที่

44 ี รงดึงดูด / แรงผลักระหว่าง 3. ไม่มแ โมเลกุล ดังนัน ้ ี าร การชนกันของโมเลกุล จึงไม่มก รับ / สูญเสีย พลังงาน เรียกว่า การชนแบบ nslation kinetic energy 1 m ยืดหยุน ่ (elastic 2 collision)

45 KINETIC PRESSURE EQUATION : P 1 Nomv2 2 Etrans KINETIC TEMPERATURE 3 V 3 EQUATION : V T mv2 2 Etrans 3k

m มวลของ 1 โมเลกุล v ความเร็วในการเคลื่อนที่ V ปริของโมเลกุ มาตรต่อ ล 46 ส No โมลของแก๊ เลขอาโวกาโดร Etrans พลังงานจลน์ในการเลื่อนที่ของ โมเลกุลใน 1 โมล -1 ค่าคงที่ของแก๊ส 8.314 J K m าคงที่ของ Boltzmann R / N0 1.381 x 10-23 J K-1 mole

47 เสรีเฉลี่ย (Mean Free Path คือ ระยะทางเฉลี่ยระหว่างการชนกัน ของโมเลกุล l V 2 เส้น1/2 ผ่านศูน2ย์กลางของโมเลก Nd

48 นิยามที่สมบูรณ์ของแก๊สอุ ดมคต ี รงดึงดูดระหว่าง แก๊สอุ ดมคติไม่มแ โมเลกุล ดังนัน ้ พลังงานภายในจะไม่ขึน ้ ถ E กับระยะทาง AL GAS EQUATION : 0 ระหว่างโมเลกุล ถV GAS EQUATION : PV แก๊สใดๆ ที่เป็นไปตามสมการทั้งสอง นี้ จัดเป็น

49 งานภายใน (Internal energy energ ี ยูใ่ นสารนัน คือ พลังงานที่มอ ้ ๆ ได้แก่ 1. พลังงานทางไฟฟ้าที่เกิดจาก แรงดึงดูดของ e กับ นิ ว เคลี ย ส และแรงผลั ก ระหว่ า ง e 2. พลังงานจลน์ที่เกิดจากการ กั บ e Eelectภ)าค เคลื่อนที(่ของอนุ Eงtrans Erot Evib) 3.(พลั งานนิ วเคลี ยร์ของ E Eelect Etrans นิวเคลียส ( Enuclear) E E E

50 ลังงานภายใน ไม่สามารถวัดได้โดยตรง วัดได้แต่ E

การแพร่ของแก๊ส 51 (DIFFUSION OF GASES) รแพร่ของแก๊สเกิดขึน ้ ได้เร็ว โดยเกิดข , P, T, n คงที่ r1 M2 d2 r2 M1 d1

52 เกิดจากความแตกต่างของ ศักย์ เคมี (chemical potential) ทำให้โมเลกุลของ ่ แก๊ ส เคลื ่ อ นที โ ดย ระบบที่เกิดการแพร่ ซึง ่ ถือว่าเป็น อิ ส ระในทิ ศ ทางต่ า งๆ กั น จนศั ก ย์ ระบบโดดเดี ว ถ้าระบบถูก่ยรบกวน และทำให้เกิดการ เคมี เ ท่ า กั น หมด ที่ V คงที่ จะเปลี แยกตั่ยวนไปอยู ของ ใ่ นภาวะ สมดุ สูงสุด) บสูภ แก๊ลส(S ระบบจะกลั ่ าวะสมดุลซึง ่ มี การกระจายตัว

สูตรทางบารอเมตริก 53 (The Barometric Formula ความดันบรรยากาศจะแปรผันกับ ความสูง าจำนวนโมเลกุ ลแปรผันมีกัอบุ ณความ ว่าถ้ในแนวตั หภูมิ T ้งของบรรยากาศ สูง P -gMh - Ep lnP RT RT 0

54 gMh Ep P lnP - RT - R 0 T P0 ,P ความดันที่ความสูง h 0 g ค่าคงที่ของแรงโน้มถ่วง และ Ehp การเปลี่ยนแปลงพลังงานศักย์ (gravitational constant) ของโมเลกุล 1 โมล จาก h 0 ถึง h โดยความดัน ่ยนจาก P เปลีM P 0 มวลโมเลกุ ล

55 Ep P lnP - R 0 T P Poe- E / RT P0e-( - 0) / kT p พลังงานศักย์เฉลี่ยของหนึ่ง โมเลกุ h ลทีE่คpวามสู / N0ง k ค่าคงที่ของ โบลต์ซมันน์ R N0

56 ที่คงที่ P ต จำนวนโมเลกุลใน 1 หน่วยปริมา N V N N 0- ( - ) / kT 0 e V V0 ถ้าหน่วยปริมาตร OLTZMANN EQUATION : คงที่ - ( 0 e N N0 ) / kT
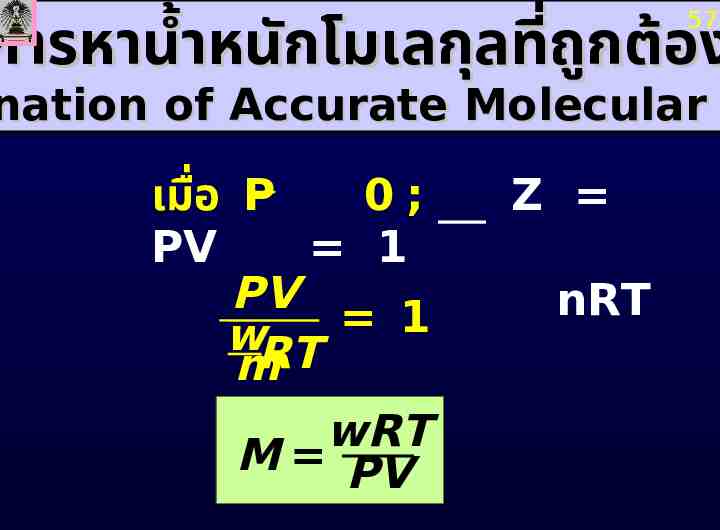
การหาน้ำหนักโมเลกุลที่ถก ู ต้อง 57 nation of Accurate Molecular เมื่อ P 0; PV 1 PV 1 wRT m wRT M PV Z nRT
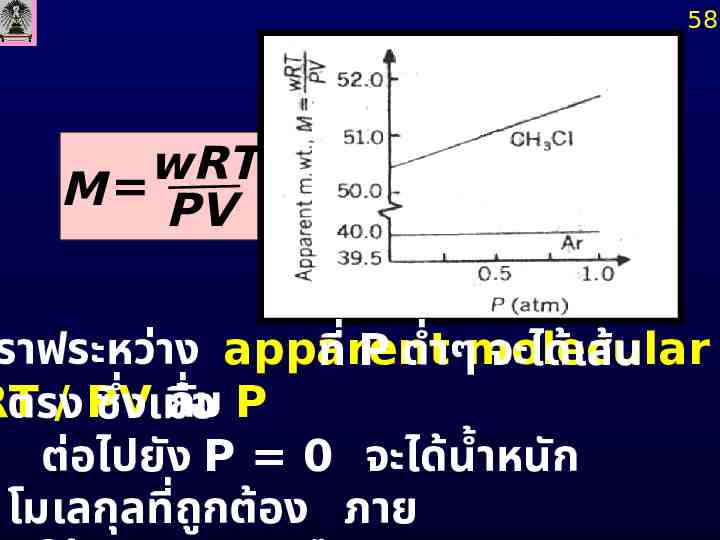
58 wRT M PV ราฟระหว่าง apparent ที่ P ต่ำๆmolecular จะได้เส้น RT / PV กั่ อบ P ตรง ซึง ่ เมื ต่อไปยัง P 0 จะได้น้ำหนัก โมเลกุลที่ถก ู ต้อง ภาย
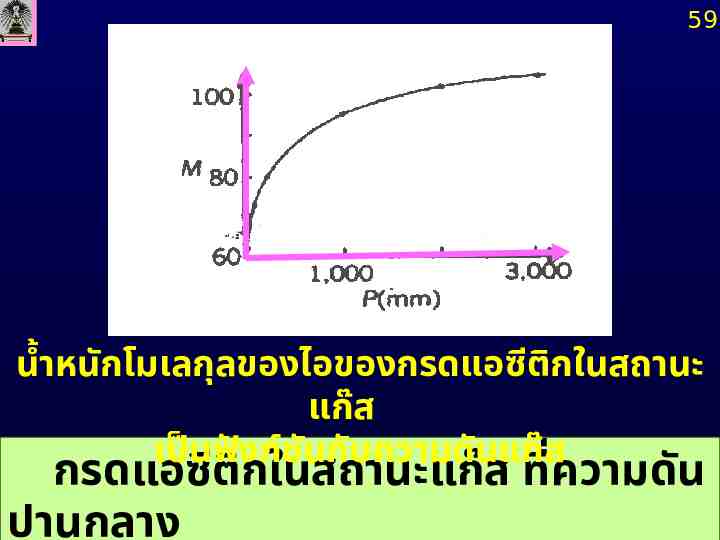
59 น้ำหนักโมเลกุลของไอของกรดแอซีติกในสถานะ แก๊ส เป็นฟังก์ชน ั กับความดันแก๊ส กรดแอซีติกในสถานะแก๊ส ที่ความดัน ปานกลาง